近日,国家药监局发布关于修订壮骨止痛胶囊和小儿咳喘灵制剂说明书的公告(2023年第45号)(以下简称《公告》),决定对壮骨止痛胶囊和小儿咳喘灵制剂说明书中的【不良反应】、【禁忌】和【注意事项】项进行统一修订。
《公告》指出,所有上述药品的上市许可持有人均应当依据《药品注册管理办法》等有关规定,按照相应附件要求修订说明书,于2023年7月17日前报省级药品监督管理部门备案。修订内容涉及药品标签的,应当一并进行修订;说明书及标签其他内容应当与原批准内容一致。自备案之日起生产的药品,不得继续使用原药品说明书。药品上市许可持有人应当在备案后9个月内对已出厂的药品说明书及标签予以更换。《公告》提醒,临床医师、药师应当仔细阅读上述药品说明书的修订内容,在选择用药时,应当根据新修订说明书进行充分的获益/风险分析。患者用药前应当仔细阅读药品说明书,使用处方药的,应当严格遵医嘱用药。一、【不良反应】项应当增加:
监测数据显示,本品有恶心、呕吐、消化不良、腹胀、腹痛、腹泻、皮疹、瘙痒、头晕等不良反应,有肝功能异常个案报告。
二、【禁忌】项应当增加:
对本品及所含成份过敏者禁用。
三、【注意事项】项应当增加:
1.用药期间如果出现全身乏力、食欲不振、厌油、恶心、上腹胀痛、尿黄、目黄、皮肤黄染等临床表现时,立即停药并到医院就诊。
2.孕妇慎用。
3.肝功能不全及既往有肝病史、药物性肝损害的患者慎用。
4.有药物过敏史或过敏体质者慎用。
5.严格按药品说明书使用,应避免与有肝毒性的药物联合用药。
一、【不良反应】项应当增加
监测数据显示,小儿咳喘灵制剂有以下不良反应报告:皮疹、瘙痒、腹泻、腹痛、腹部不适、恶心、呕吐、口干、食欲减退、头晕、头痛、乏力、过敏反应等。
二、【禁忌】项应当增加
对本品及所含成份过敏者禁用。
三、【注意事项】
(一)处方药说明书【注意事项】应当增加
1.风寒感冒者慎用。
2.运动员慎用。
(二)非处方药说明书【注意事项】应当增加
1.脾虚易腹泻者应在医师指导下服用。风寒感冒者慎用。
2.发热体温超过38.5℃的患者,应去医院就诊。
3.运动员慎用。
(三)泡腾片、泡腾颗粒说明书【注意事项】应当增加
按照用法用量服用,严禁直接吞服或含服。
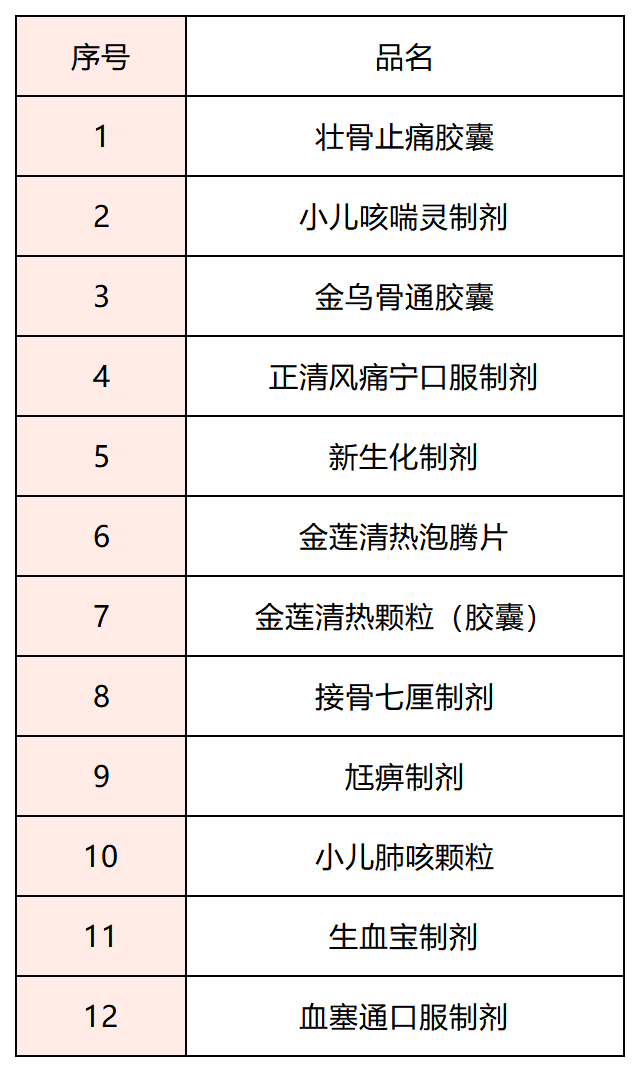
搜药查阅,今年以来,除了上述公告,国家药监局还发布了4次修订制剂说明书的相关公告,共有12种制剂的说明书进行修订。近年来,药监局严格规范药品说明书安全信息项存在“尚不明确”表述的情形,并着手对百余种药品说明书中的“禁忌”“不良反应”“注意事项”等内容进行了统一修订。2022年初,国家药监局发《已上市中药说明书安全信息项内容修订技术指导原则(试行)》的通告,明确提出,随着已上市中药的广泛使用,其安全性信息不断累积,一些新的用药风险也被发现,需及时修订已上市中药说明书的安全信息项内容。同时,对中药说明书修改的具体原则、方法、路径进行了明确指导。2022年11月11日,国家药监局再度对《中药注册管理专门规定》征求意见。第七十七条【明确已上市中药说明书的完善要求】提出,中药药品上市许可持有人应当加强对药品全生命周期的管理,加强对安全性风险的监测、评价和分析,应当参照相关技术指导原则及时对说明书【禁忌】、【不良反应】、【注意事项】进行完善。同时强调,中药说明书【禁忌】、【不良反应】、【注意事项】中任何一项在申请药品再注册时仍为“尚不明确”的,不予再注册。业内人士判断,在修改中药说明书的背景下,中药企业或将呈现两极分化之势,一部分扎堆修订说明书,一部分则选择放弃。
关键字: